
DRA. ROSA GASA
Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS)
AVANCES EN EL ÚLTIMO AÑO
Avances en el proyecto de la Dra. Rosa Gasa
TERAPIA CELULAR EN DIABETES: NUEVAS ESTRATEGIAS PARA GENERAR CÉLULAS BETA SUSTITUTAS Y OPTIMIZACIÓN DEL TRASPLANTE
Actualizado: diciembre 2022
1. Introducción
Una propuesta de futuro para la cura de la Diabetes tipo 1 contempla la restitución de la producción endógena de insulina mediante la regeneración de las células beta del páncreas o el reemplazo de las mismas con otras células que puedan ejercer su función. Con ello, la persona con diabetes no necesitaría administrarse insulina diariamente. En la actualidad nuestro equipo está investigando dos estrategias con el fin de lograr este objetivo. La primera es la creación de células beta sustitutas en el laboratorio a partir de células de la piel. La segunda es la expansión de las células beta remanentes en el páncreas o de las células generadas en el laboratorio mediante la estimulación de su replicación. La financiación recibida de DiabetesCERO se ha destinado a la primera de estas estrategias.
Los miembros del equipo durante el periodo 2021-2022 han sido:
- Marta Fontcuberta-PiSunyer, investigadora postdoctoral (IDIBAPS)
- Ainhoa García-Alamán, estudiante de doctorado (CIBERDEM)
- Rebeca Fernández-Ruiz, investigadora posdoctoral (CIBERDEM)
- María Reyes Boturu, estudiante de máster (UB)
- Rosa Gasa, investigadora principal (IDIBAPS)

Equipo de investigación IDIBAPS.
2. Avances 2021-2022
2.1. Optimización del protocolo de reprogramación con moléculas solubles.
Justificación: Es necesario aumentar el estado de diferenciación y maduración de las células fibro-beta para que se asemejen más a una célula beta primaria y esta estrategia pueda ser una alternativa viable para crear células productoras de insulina sustitutas. Proponemos optimizar el protocolo actual mediante la implementación de modificaciones sencillas como es la adición de moléculas solubles.
Hasta el momento hemos analizado los efectos de un total de 20 moléculas. Estas moléculas se han seleccionado en base a publicaciones científicas previas donde se muestra que facilitan cambios de linaje celular (en nuestro caso, necesitamos pasar de una células de estirpe mesodérmica, el fibroblasto, a una célula de estirpe endodérmica, la célula beta) o que mejoran la eficiencia de derivación y de maduración de células beta a partir de células madre embrionarias. Son moléculas que afectan procesos epigenéticos (concretamente metilación del DNA y de histonas) y moléculas que regulan vías de señalización intracelular.
Hemos identificado una combinación de cinco moléculas (barra en color azul en gráfico inferior) que añadidas durante los últimos tres días del protocolo de reprogramación aumentan sensiblemente la activación del gen de la insulina en las células fibro-beta.
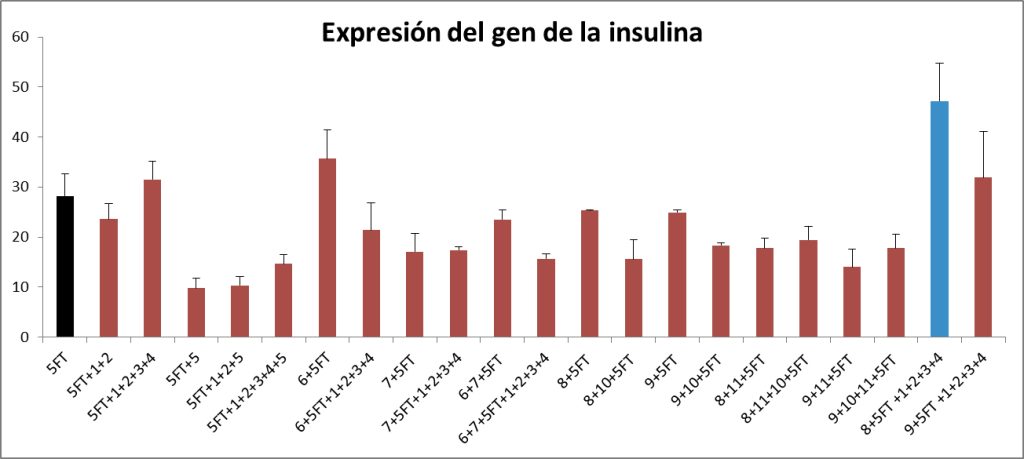
Figura 2.
Efectos de la adición de distintas moléculas solubles, indicadas con números, sobre la activación del gen de la insulina en células fibro-beta. “5TF” se refiere al protocolo de reprogramación establecido en el laboratorio. Los niveles de expresión de insulina en el protocolo 5TF se muestran con la barra de color negro. De las distintas combinaciones estudiadas, la que se muestra en color azul ha sido escogida para estudiar con más detalle. Los resultados corresponden a dos-cuatro experimentos independientes. Las barras de errores indican error medio estándar.
Interesantemente, esta combinación de cinco moléculas aumenta también la expresión del gen del factor de transcripción específico de célula beta NKX6-1 y de genes implicados en el procesamiento (PCSK1) y secreción de insulina (ABCC8, GLP1R). Estos datos apuntan a que la adición de moléculas es una buena estrategia para mejorar el grado de diferenciación de las células fibro-beta.
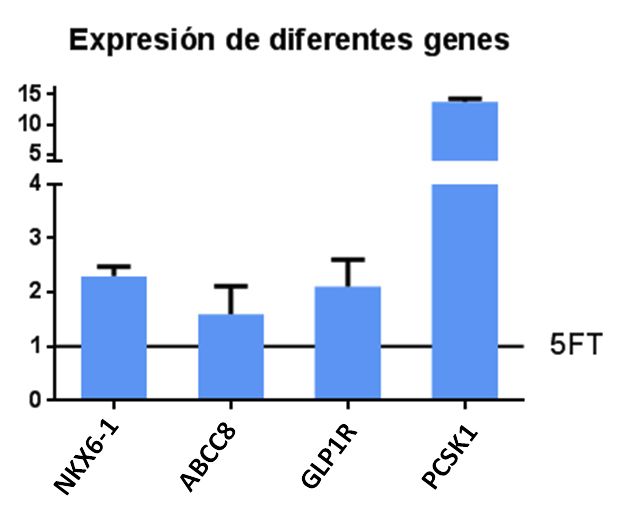
Figura 3.
Comparación de los niveles de expresión de los genes indicados entre células fibro-beta obtenidas según el protocolo 5TF original o el protocolo 5TF-modificado mediante la adición de 5 moléculas solubles. Los valores indican las veces que aumenta la expresión del gen respecto al protocolo 5TF (valor de 1, representado por la línea horizontal). Los resultados corresponden a dos-cuatro experimentos independientes. Las barras de errores indican error medio estándar.
2.2. Mejora del trasplante mediante la optimización del proceso de vascularización.
Justificación: La vascularización del injerto tras el trasplante es un paso imprescindible para asegurar la supervivencia del mismo a largo plazo. La creación de nuevos vasos es necesaria para permitir la llegada de oxígeno y nutrientes a las células trasplantadas así como para la recogida de productos de desecho de las mismas. Precisamente una de las causas principales de la pérdida de islotes pancreáticos trasplantados es la capacidad limitada para crear nuevos vasos. Este punto es aún más crítico en el caso del trasplante de células generadas a partir de células madre o por transdiferenciación, ya que éstas no tienen red vascular de origen.
Con el fin de solventar este problema, proponemos trasplantar células endoteliales (forman vasos sanguíneos) junto con las células fibro-beta. Para ello, hemos creamos esferoides quiméricos en el laboratorio que contienen células HUVEC (céllulas endoteliales de cordón umbilical humano) y células fibro-beta tal como se representa en el dibujo.
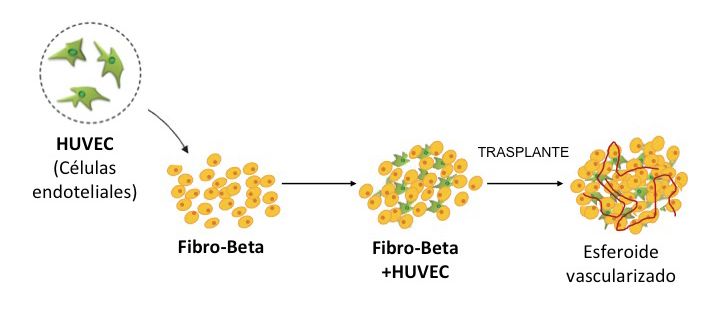
Figura 4.
Esquema del experimento realizado con el fin de mejorar la vascularización del implante celular.
Los resultados obtenidos hasta el momento muestran que los injertos de esferoides compuestos de HUVEC+Fibro-beta exhiben una mayor proporción de vasos sanguíneos en comparación con los injertos de esferoides de células fibro-beta (ver gràfica). Además el área de células viables es superior en el implante HUVEC+Fibro-beta, lo que sugiere la disminución de la muerte celular en esta condición.
Estos resultados indican que la inclusión de células endoteliales es una estrategia válida para acelerar la vascularización de las células fibro-beta tras el trasplante.
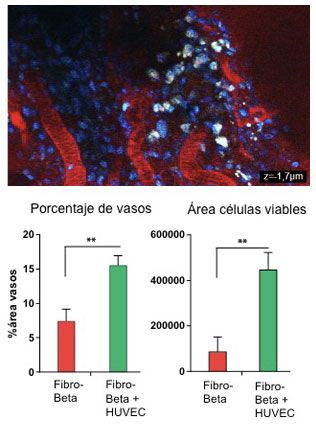
Figura 5.
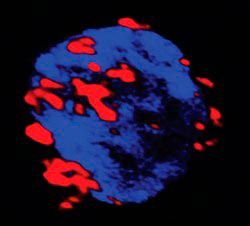
Imagen de un implante celular a día 10 después del trasplante en la cámara anterior del ojo de un ratón. Se distinguen en rojo los vaso sanguíneos funcionales y en color blanco las células fibro-beta trasplantadas. Los gráficos muestran la densidad de vasos (izquierda) y el área total de células viables (derecha) 10 días después del trasplante de esferoides con células fibro-beta (en rojo) o células fibro-beta+HUVEC (en verde). Los resultados corresponden a cuatro implantes distintos. Las barras de errores indican error medio estándar.
3. Conclusiones
En conclusión, durante esta primera anualidad hemos conseguido progresos importantes en los
dos objetivos planteados. Por un lado, hemos identificado una serie de moléculas que
mejoran los niveles de expresión de marcadores beta en las células productoras de insulina reprogramadas a partir de fibroblastos de piel. Por otro lado, hemos comprobado que la
inclusión de células endoteliales mejora la vascularización de los implantes de las células
reprogramadas tras el trasplante.
4. Experimentos planteados para la segunda anualidad
Durante la segunda anualidad pretendemos seguir avanzando en los objetivos específicos planteados en el proyecto. En concreto:
- Caracterización de las células creadas con el nuevo protocolo de reprogramación:
ultraestructura mediante microscopio electrónico, análisis transcriptómico global, ensayos de mobilización de calcio intracelular, secreción de insulina in vitro e in vivo. - Mejora de la vascularización del injerto mediante la inclusión de células adicionales a
las células endoteliales, como por ejemplo pericitos, y la administración de fármacos
inductores de la vascularización. Estudio del efecto de estas estrategias sobre la supervivencia del trasplante a largo plazo de las células reprogramadas.

Dra. Rosa Gasa
IDIBAPS
Generación de células productoras de insulina a partir de células de la piel. Diseño de un armazón y mejora de la revascularización mediante inhibición de PTP1B.
LOS OTROS
PROYECTOS DE INVESTIGACIÓN
QUE FINANCIAMOS

Dr. Benoit Gauthier
CABIMER
Activación de LRH1 mediada por BL001 para promover la transdiferenciación de células alfa a células beta en un modelo de diabetes autoinmune.
¡Conoce las últimas novedades!

Dra. Marta Vives
IGTP
Nanopartículas tipo liposoma que reeducan el sistema inmunológico para permitir la regeneración de las células beta.
¡Conoce las últimas novedades!
Yo también investigo...
¿y tú?
Juntos podremos encontrar una cura para la diabetes tipo 1.




