
DRA. ROSA GASA
Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS)
El proyecto de Rosa Gasa
TERAPIA CELULAR EN DIABETES: NUEVAS ESTRATEGIAS PARA GENERAR CÉLULAS BETA SUSTITUTAS Y OPTIMIZACIÓN DEL TRASPLANTE
1. Resumen del proyecto
¿Qué problemas plantea el trasplante de donante? Podríamos considerar tres:
1) Imposible conseguir suficiente número de islotes. Necesitaríamos 3-4 donantes por paciente !!
2) Para evitar el rechazo es obligado un tratamiento inmunosupresor que, a largo plazo, puede poner en riesgo la vida del paciente.
3) La vida de los islotes trasplantados es corta, menor de un año, y ello es debido –en parte- a una red de vasos sanguíneos insuficiente para mantener con vida el injerto.
La escasez de islotes humanos de donante ha motivado la búsqueda de fuentes de células beta alternativas. Proponemos la conversión de células de la piel del propio paciente en células beta sustitutas mediante un proceso denominado “reprogramación directa”. Hasta el momento, las células madre pluripotentes han sido la fuente celular elegida para lograr células beta dada su capacidad para generar cualquier célula del cuerpo. Sin embargo, su pluripotencia lleva asociado el riesgo de formación de tumores. Además, lleva mucho tiempo conseguir células beta maduras y no siempre es posible. La “reprogramación directa” es una técnica que, de lograr que funcione, sería más sencilla y rápida, sin el riesgo de que se produzca tumor y, como esta célula beta procedería de la piel del propio enfermo no habría rechazo.
El éxito del trasplante depende de la supervivencia del injerto. Se sabe que una red de vasos pobre impide la oxigenación y la nutrición adecuada de las células trasplantadas. El principal responsable de la formación de esta red es el factor de crecimiento del endotelio vascular A (VEGFA) liberado por la célula beta. Nuestra propuesta está encaminada a promover la expresión regulada de esta sustancia (VEGFA) en las células beta y con ello lograr la supervivencia de las células beta trasplantadas, durante largo tiempo.
2. Grupo de investigación
El grupo de investigación está acreditado como grupo líder en el Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS)-Instituto de Investigaciones Sanitarias ISCiii y en el Hospital Clínic de Barcelona. También forma parte de CIBERDEM. Es un equipo de investigación multidisciplinario centrado en la investigación biomédica traslacional en el campo de la diabetes y la obesidad. El grupo recibe y ha recibido financiación de agencias públicas nacionales e internacionales (Plan Nacional, FIS, EU y CIRIT), así como de fondos privados y colabora con importantes grupos de investigación, nacionales e internacionales.
Desde la constitución del grupo el año 1984, una de las líneas de investigación prioritarias ha sido el estudio de los determinantes moleculares y metabólicos de la célula ß y su funcionalidad en modelos humanos y experimentales. El grupo fue pionero en el aislamiento de islotes pancreáticos humanos en España y en el estudio de la fisiopatología de la célula ß. También desarrolló proyectos en el ámbito del trasplante de islotes en roedores con el fin de mejorar la revascularización y supervivencia del injerto. Fruto de su labor investigadora ha conseguido identificar diferentes dianas terapéuticas para el tratamiento de la diabetes y la obesidad, patentando y, en algún caso licenciando, su aplicación. En los últimos años ha puesto especial énfasis en elucidar los mecanismos que regulan la masa de células ß con el fin de identificar dianas críticas que intervienen en el proceso de regeneración y crecimiento celular, lo que puede permitir la recuperación del islote pancreático dañado en pacientes diabéticos.
Uno de los valores más destacados del grupo es su amplio conocimiento de modelos animales (adultos y embrionarios), diabéticos y obesos (genéticos espontáneos, inducidos por tóxicos, o modificados en sus genes) para el estudio de la diabetes. Asimismo, el grupo ha destacado en la investigación con islotes pancreáticos humanos, paso clave en cualquier estudio traslacional en el campo de la diabetes. El grupo ha desarrollado técnicas de aislamiento y cultivo de islotes pancreáticos procedentes de donantes humanos y de modelos animales. Asimismo, tiene probada experiencia en el uso de técnicas de biología celular, inmunohistoquímica y biología molecular aplicadas al análisis de los mecanismos de señalización y función del islote pancreático, así como en el uso de de plataformas de genómica, proteómica y metabolómica y la integración bioinformática de los datos aportados por estas tecnologías ómicas.

Equipo de investigación IDIBAPS.
Artículos previos relacionados con diabetes tipo 1 y estrategias de curación
Hemos seleccionado 5 artículos recientes representativos de investigaciones enmarcadas en el campo de la regeneración (proliferación, supervivencia y diferenciación) de la célula ß pancreática:
- Fernández-Alvarez J, Barberà A, Nadal B, Barceló-Batllori S, Piquer S, Claret M, Guinovart JJ, Gomis R. Stable and functional regeneration of pancreatic beta-cell population in nSTZ- rats treated with tungstate. Diabetologia. 2004 Mar;47(3):470-7.
- Pardo F, Altirriba J, Garcia A, Ahlgren U4, Slebe J, Yañez A, Gasa R* Gomis R*. Connection between the Raf-1 Kinase Inhibitor Protein in the regulation of pancreatic beta cell proliferation in mice. Diabetologia 55: 3331-40 (2012)
- Rebuffat SA, Oliveira JM, Altirriba J, Palau N, Garcia A, Esteban Y, Nadal B, Gomis R. Downregulation of Sfrp5 promotes beta cell proliferation during obesity in the rat. Diabetologia. 2013 Nov;56(11):2446-55.
- Oliveira JM, Rebuffat SA, Gasa R, Burks DJ, Garcia A, Kalko SG, Zafra D, Guinovart JJ, Gomis R. Tungstate promotes b cell survival in Irs2 -/- mice. Am J Physiol Endocrinol Metab. 2014 Jan 1;306(1):E36-47.
- Pujadas, G., Cervantes, S., Tutusaus, A., Ejarque, M., Sanchez, L., Garcia, A., Esteban, Y., Fargas, L., Alsina, B., Hartmann, C., Gomis, R., Gasa, R. Wnt9a discloses a repressive role of Tcf7l2 on endocrine differentiation in the embryonic pancreas. Scientific Reports 6: 19223 (2016)
Composición y organización del equipo de investigación involucrado en este proyecto.
El equipo que realizará el proyecto propuesto está compuesto por un investigador principal (Rosa Gasa), dos investigadores predoctorales (Marta Fontcuberta e Hugo Figuereido) y dos técnicos de laboratorio (Yaiza Esteban y Ainhoa García). Rosa Gasa (IDIBAPS), investigadora asociada al grupo liderado por el Dr. Gomis desde el año 2004, posee una amplia experiencia en el estudio de la célula ß, tanto en el aspecto funcional como en su ontogénesis durante el desarrollo embrionario y etapa posnatal temprana. Durante los últimos 3 años ha liderado el proyecto dedicado a la reprogramación de fibroblastos humanos. Hugo Figuereido ha desarrollado su trabajo doctoral bajo la dirección del Dr. Gomis en el campo del trasplante de islotes pancreáticos, concretamente en la inhibición de la fosfatasa PTP1B como estrategia para mejorar la revascularización del injerto de islotes. Marta Fontcuberta desarrolla su tesis doctoral sobre la reprogramación de fibroblastos humanos bajo la dirección de la Dra. Gasa. Yaiza Esteban (CIBERDEM-IDIBAPS), tiene amplia experiencia en técnicas de biología molecular y celular, y Ainhoa García (CIBERDEM-IDIBAPS) está especializada en trabajo con modelos animales experimentales. Yaiza y Ainhoa darán apoyo técnico a Hugo y Marta los cuales serán supervisados directamente por la Dra.Gasa.
Medios disponibles para la realización del proyecto
El conocimiento y la tecnología que se requiere para el desarrollo del proyecto están disponibles en el laboratorio. Para la reprogramación de fibroblastos, disponemos de los vectores adenovirales necesarios y hemos establecido las condiciones óptimas de transducción. También disponemos de conocimiento extenso en análisis de la secreción de insulina, test metabólicos y trasplantes. Para el diseño y construcción del armazón biomimético para el trasplante contaremos con la colaboración de la Dra. Martinez del IBEC, Barcelona, que dirige un equipo con amplio conocimiento de esta tecnología (http://www.ibecbarcelona.eu/ biomsyscelleng). Asimismo disponemos del espacio físico y del aparataje necesario para realizar el proyecto tal como se detalla en el último apartado de la propuesta.
3. Proyecto de investigación
INTRODUCCIÓN
a) Objetivo general
El objetivo general del proyecto es investigar estrategias innovadoras de terapia celular para la DT1 basadas en la generación de células productoras de insulina a partir de células de la piel del propio paciente y su posterior trasplante utilizando un armazón biocompatible combinado con una estrategia genética que permita y promueva la vascularización del injerto.
b) Estado actual del tema
Para el paciente con DT1 que depende de la administración diaria de insulina exógena para sobrevivir, el trasplante de islotes pancreáticos constituye el tratamiento más esperanzador. Sin embargo, a pesar del éxito obtenido en la reducción de episodios hipoglucémicos y en el enlentecimiento en la aparición de complicaciones crónicas, hay tres limitaciones importantes que dificultan su aplicación general: el número reducido de donantes en relación al de receptores potenciales, la necesidad de inmunosupresión tras el trasplante y la pobre supervivencia del injerto. Por ello, es necesario desarrollar estrategias combinadas que permitan, por un lado, generar células secretoras de insulina en cantidades suficientes, y por otro, mantener su supervivencia y función a largo plazo tras el trasplante.
Actualmente están siendo investigadas fuentes de células ß alternativas a los islotes humanos como las células madre embrionarias (ESC), las células pluripotentes inducidas (iPSC) y los islotes xenogénicos. Recientes avances en el desarrollo de protocolos de derivación de células ß a partir de ESC apoyan el potencial de esta estrategia para una traslación clínica a corto plazo1,2. No obstante, siguen existiendo grandes retos, como la inmadurez funcional de las células β generadas, el riesgo de teratomas y el rechazo tras el trasplante.
La transdiferenciación o reprogramación directa es la conversión de un tipo de célula especializada o somática en otra sin pasar por un estado pluripotente (similar al de ESC o iPSC). Se basa en la expresión de combinaciones de factores de transcripción (FT) encargados de regular la expresión de genes y que participan en la formación del tipo celular de interés durante la embriogénesis. Dentro de este marco conceptual, cualquier célula podría ser convertida en otra si se conoce la combinación de FT adecuada. Así, se han generado neuronas, hepatocitos y cardiomiocitos a partir de fibroblastos de piel3,4. La reprogramación directa a partir de fibroblastos ofrece varias ventajas: a) los fibroblastos se pueden obtener fácilmente a partir de biopsias de piel del antebrazo o de la nalga y también se expanden fácilmente in vitro; b) una vez reprogramados hacia la célula de interés pueden ser trasplantados al mismo donante evitando así el rechazo y c) al no pasar por un estadio pluripotente como las ESC y iPSC no hay riesgo de tumorogénesis.
En el campo de la diabetes, se ha conseguido la conversión de células exocrinas hacia células productoras de insulina mediante la introducción de los FT Pdx1, Ngn3 y MAFA (llamados PNM)5, y también a partir de otros linajes celulares embriológicamente cercanos como células ductales pancreáticas, hepáticas, estomacales o intestinales6-10. En cambio, la generación de células productoras de insulina a partir de fibroblastos de piel ha sido poco explorada, si bien se ha descrito que los factores PNM no consiguen transdiferenciar fibroblastos murinos hacia células ß5,11.
La revascularización deficiente de los injertos de islotes/células (impidiendo su correcta oxigenación y nutrición) es una de las razones por la que éstos ven comprometida su supervivencia y funcionalidad post-trasplante12,13. El principal factor responsable de la revascularización a partir de vasos sanguíneos cercanos al injerto (angiogénesis) es el factor de crecimiento del endotelio vascular A (VEGFA), que en los islotes, es producido y liberado, por la célula ß14,15. El VEGFA interacciona con su receptor, VEFGR2, localizado en las células endoteliales de los vasos cercanos, activando la angiogénesis. Este proceso ha sido demostrado recientemente que es regulado por la proteína tirosina fosfatasa 1B (PTP1B)16-17. Actualmente, los estudios publicados se basan en la sobreproducción de VEGFA. Sin embargo, estos estudios no han dado resultados muy alentadores ya que la hipervascularización conseguida provoca un fallo funcional y muerte de las células del injerto19-21. Así pues, es crítico un control fino del grado de vascularización que permita evitar la muerte celular que se da tanto por deficiencia como por exceso de angiogénesis.
c) Novedad del proyecto
La dos estrategias propuestas: (i) reprogramación directa de fibroblastos dérmicos hacia células productoras de insulina e (ii) inhibición de PTP1B para la promoción de la vascularización del injerto celular son novedosas en tanto que no hay estudios previos publicados que las hayan abordado. En estos momentos, se ha avanzado mucho en el campo de las células madre embrionarias y células iPSC (pluripotentes generadas a partir de fibroblastos) como fuente de células beta para trasplante. La reprogramación directa que proponemos ha sido menos explorada a pesar de que en otros campos está dando resultados muy prometedores. Por otro lado, el uso de VEGFA como promotor de revascularización no es nuevo. Sin embargo, nuestra estrategia basada en promover su expresión endógena moderada es innovadora. Con una expresión controlada pretendemos evitar los efectos nocivos de la sobreproducción excesiva de VEGFA ensayada en otros estudios.
d) Hipótesis
Nuestra hipótesis es que es posible reprogramar fibroblastos humanos a células productoras de insulina para ser trasplantadas con el fin de curar la diabetes. Asimismo, en base a los conocimientos disponibles y a nuestros propios datos preliminares, proponemos que la inhibición temporal de PTP1B puede ser una estrategia válida para mejorar la revascularización del implante celular y con ello optimizar su supervivencia y funcionalidad.
OBJETIVOS ESPECÍFICOS Y DESARROLLO DEL PROYECTO
a) Los objetivos específicos que proponemos desarrollar esta anualidad son:
Caracterizar la función in vitro de los fibroblastos reprogramados a célula beta (células fibro-beta o CFB).
Caracterizar la función in vivo de las CFB.
Determinar el efecto de la inhibición de PTP1b sobre la expresión y producción
de VEGFA en las CBF y sobre la vascularización y supervivencia del implante celular.
b) Datos preliminares
Nuestra propuesta se basa en los siguientes resultados no publicados:
b1) Diseño de un protocolo de reprogramación directa de fibroblastos humanos hacia células fibro-beta (CFB) basado en la introducción secuencial de cinco FT. En las CFB el gen de la INSULINA y otros genes marcadores de célula ß son activados, hay síntesis y procesamiento de insulina, y una disminución de la expresión de FT característicos de fibroblastos (Figura 1).
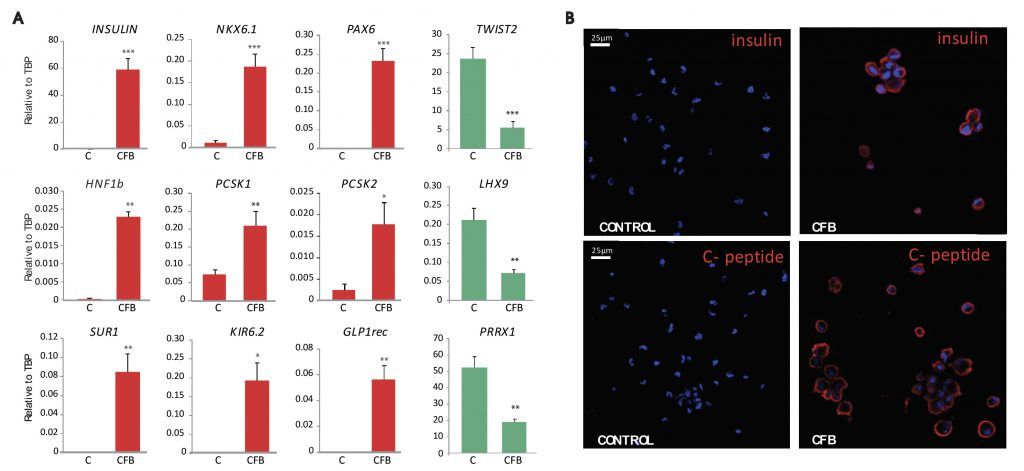
Figura 1: A) Expresión del gen de la INSULINA y de otros genes característicos de célula ß (en rojo) y de genes reguladores del programa transcripcional fibroblástico (en verde) en fibroblastos primarios (control/C) y en células CFB. B)
Immunofluorescencia para INSULINA y PÉPTIDO C en fibroblastos y células CFB.
b2) La inhibición de la fosfatasa PTP1B en células ß murinas y humanas promueven la expresión endógena del gen codificante de VEGFA. Este efecto comporta la mejora de la revascularización del injerto de islotes pancreáticos y consecuente remisión de la diabetes, tras el trasplante en modelos animales (Figura 2).
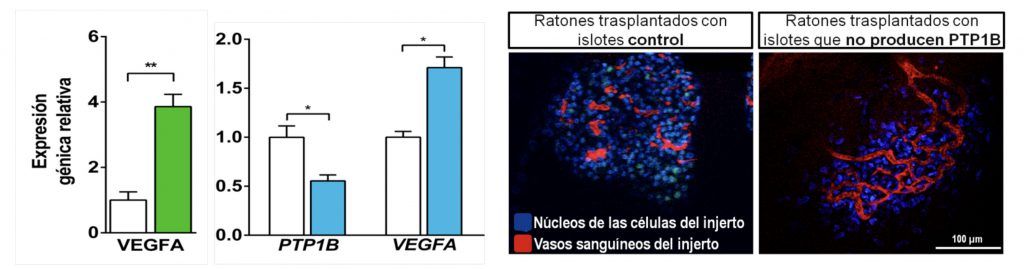
Figura 2: A) Expresi.n de VEGFA en islotes de ratones que no producen la PTP1B (barra verde) o en islotes humanos con la expresi.n de PTP1B inhibida (barra azul; controles – barra blanca); B) Revascularizaci.n de los injertos, valorada por microscopia de dos fotones, utilizando marcadores fluorescentes para visualizar, los n.cleos de las c.lulas de los injertos (azul) y los vasos sangu.neos formados en el injerto (rojo).
c) Desarrollo del proyecto
Todos los experimentos propuestos se realizarán con células CFB generadas a partir de fibroblastos control (HFF10.1) y de fibroblastos obtenidos de un paciente con DT1 (D1.13) según el protocolo ya establecido (ver datos preliminares). El proyecto será desarrollado con base a decisiones go-no-go, consecuencia de los resultados obtenidos en los experimentos planeados dentro de cada objetivo específico.
Objetivo 1.
Exp.1.1 Secreción de insulina de las CBF en respuesta a glucosa (GSIS; 2/20mM), despolarizadores de membrana (KCl), sulfonilureas o aminoácidos (Leu,Gln) entre otros. Se medirá mediante incubación estática (90min). Se comparará la secreción de las CBF mantenidas en monocapa o en estructuras tridimensionales (metodología de «hanging drop»). La insulina secretada y el contenido celular de insulina (extracción mediante ácido-alcohol) de determinarán por ELISA.
Exp.1.2 Ultraestructura de las CBF mediante microscopia electrónica (m.e). Las células CBF fijadas se enviarán a la Dra. A. Clark de la Universidad de Oxford, especialista en m.e. de la célula β. Se determinará la presencia de gránulos de secreción de insulina característicos.
Exp.1.3 Evaluación de flujo de calcio en las CBF. Se introducirá en las células un indicador-sonda permeable (Calcium GreenTM) que emite fluorescencia cuando se une a calcio. La señal fluorescente en respuesta a glucosa se medirá mediante microscopía confocal.
Objetivo 2.
Exp.2.1 Trasplante de 2-5×106 células CBF (en base a publicaciones previas), en suspensión o en forma de agregados, bajo la càpsula renal de ratones inmunodeprimidos NOD-SCID. Se hará seguimiento (peso, glicemia) durante 12 semanas. Se medirá péptido C humano circulante a 4/8/12 semanas. Se determinará respuesta secretora a glucosa a las 8/12 semanas. Se recuperará implante a las 12 semanas para su estudio (immunofluorescencia INSULINA, PEPTIDO C, TUNEL).
Exp.2.2. Prevención de la diabetes inducida por estreptozotocina (STZ). Un mes después del trasplante, se administrará una inyección intravenosa de STZ (150 mg/ Kg, para eliminar las células β endógenas). Se monitorizarán los niveles de glucosa en sangre durante cuatro semanas adicionales. La diabetes se diagnosticará cuando la glucosa en sangre > 250 mg/dl durante 3 lecturas consecutivas. Al final de las cuatro semanas, se retirará el injerto trasplantado y se analizará histológicamente como se describe en Exp.2.1.
Objetivo 3.
Exp.3.1 Efecto del cultivo en presencia de un inhibidor de PTP1B (Merck-KGaA) sobre la expresión endógena del gen de VEGFA (mediante PCR a tiempo real) y producción de la proteína VEGFA ( mediante ELISA) en las células CBF.
Exp.3.2 Transfección de un pool de siRNAs específicos para PTP1B sobre la expresión y producción de VEGFA como se detalla en Exp.3.1. El efecto se ensayará en células CBF en monocapa y en estructura tridimensional.
Exp.3.3. Trasplante de células CBF pre-transfectadas con siRNAs anti-PTP1b en ratones NOD-SCID y evaluación de la revascularización en las semanas 1,2 y 4 semanas post-trasplante. Este experimento solamente se realizará si experimentos previos demuestran la regulación de VEGFA por PTP1B en las CBF.
Calendario de desarrollo del proyecto:
Objetivos | Meses | Investigadores implicados | ||||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | Equipo | Colaborador | |
Obj.1 | X | X | X | X | X | X | MF,YE,RG | A.Clark | ||||||
Obj.2 | X | X | X | X | X | X | X | X | X | MF,AG,RG | ||||
Obj.3 | X | X | X | X | X | X | X | HF, MF,YE | ||||||
Nota: Una vez alcanzados estos objetivos, la etapa siguiente será el diseño de una armazón combinando una matriz de colágeno donde se incorporarán las células CFB y una capa de polietilenglicol (PEG) con microvesículas de alginato que servirán como vehículo para administrar localmente un inhibidor de PTP1B, proporcionando así, un ambiente ideal para promover la revascularización del injerto. Estos experimentos no se contemplan dentro de esta primera anualidad.
Facilidades de las que se va a disponer
El grupo tiene su laboratorio en el Centro Esther Koplovitz (CEK), de reciente inauguración (verano 2010), el cual cuenta con unas instalaciones adecuadas y completamente equipadas, estando dotado con los equipos más modernos y competitivos para el desarrollo de la investigación biomédica.
Además del aparataje básico para la investigación en el campo de la biología molecular y celular (campanas de cultivo, microscopios de fluorescencia, lupas binoculares, sistemas de electroforesis, centrífugas…), el centro también cuenta con equipos de más alto nivel como microscopio confocal, varias PCR de tiempo real, aparato Luminex etc. El edificio también dispone de una sala de cultivos específica para la manipulación de agentes virales. Cuenta asimismo con diversas plataformas científicas (http://www.idibaps.org/core-facilities) así como un Biobanco para el almacenamiento de las muestras biológicas.
El IDIBAPS también tiene acceso al uso de las instalaciones de los Centros Científicos y Tecnológicos de la Universidad de Barcelona, entre los que se encuentran el Servicio de Estabulario (con instalaciones SPF y animalario convencional) situado en la planta 6 de la Facultad de Medicina, muy cerca del edificio CEK donde se mantienen todas las colonias de ratones y el Servicio de Microscopía (con microscopio electrónico y microscopio confocal).
BIBLIOGRAFÍA
- Pagliuca FW, Millman JR, Gurtler M et al. (2014) Cell 159: 428-439.
- Rezania A, Bruin JE, Arora P, et al. (2014) Nat Biotechnol 32: 1121-1133.
- Graf T (2011) Cell Stem Cell 9: 504-516.
- Xu J, Du Y, Deng H (2015) Cell Stem Cell 16: 119-134. 12.
- Zhou Q, Brown J, Kanarek A, Rajagopal J, Melton DA (2008) Nature 455: 627-632.
- Gasa R, Mrejen C, Leachman N et al. (2004) Proc Natl Acad Sci U S A 101: 13245-13250.
- Heremans Y, Van De Casteele M, in’t Veld Pet al. (2002) J Cell Biol 159: 303-312.
- Yechoor V, Liu V, Espiritu C, Paul A, Oka K, et al. (2009) Dev Cell 16: 358-373.
- Collombat P, Xu X, Ravassard P et al. (2009) Cell 138: 449-462.10
- Chen YJ, Finkbeiner SR, Weinblatt D et al. (2014) Cell Rep 6: 1046-1058.
- Katz LS, Geras-Raaka E, Gershengorn MC (2013) Stem Cells Dev 22: 2551-2560. 12 Wang X, Meloche M, Verchere CB et al (2011) J Transplant2011: 1-7
- Warnock GL, Liao YHT, Wang X et al. (2007) World J Surg. 31: 1569–76. 14Brissova M, Shostak A, Shiota M et al. (2006) Diabetes 55: 2974–2985.
- Vasir B, Jonas JC, Steil GM, et al. (2001)Transplantation 71: 924–35.
- Sugano M, Tsuchida K, Makino N. (2004) J Cardiovasc Pharmacol 44: 460–5.
- Nakamura Y, Patrushev N, Inomata H, et al. (2008) Circ Res . 102 : 1182–119
- Reinert RB, Cai Q, Hong J-Y, et al. (2014) Development. 141: 1480–91.
- Agudo J, Ayuso E, Jimenez V, et al. (2012) Diabetes. 61: 2851–61.
- Brissova M, Aamodt K, Brahmachary P, et al. (2014) Cell Metab 19: 498–511.
- Cai Q, Brissova M, Reinert RB, Pan FC, et al. (2012) Dev Biol 367: 40–54.

Primera visita de miembros de DiabetesCERO a los laboratorios de IDIBAPS. En la imagen, junto a las personas que forman el equipo de investigación.
Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS)
DiabetesCERO
INVESTIGACIONES QUE FINANCIAMOS

Dra. Rosa Gasa
IDIBAPS
——
Generación de células productoras de insulina a partir de células de la piel. Diseño de un armazón y mejora de la revascularización mediante inhibición de PTP1B.

Dr. Benoit Gauthier
CABIMER
——
Activación de LRH1 mediada por BL001 para promover la transdiferenciación de células alfa a células beta en un modelo de diabetes autoinmune.

Dra. Marta Vives
IGTP
——
Nanopartículas tipo liposoma que reeducan el sistema inmunológico para permitir la regeneración de las células beta.

Estela Rosell
Universitat de Lleida / IRB Lleida
——
Desarrollo de una microbioterapia efectiva para el tratamiento de la diabetes tipo 1.

Dra. Mireia Ramos
Universitat Pompeu Fabra
——
Entender la heterogeneidad de las células beta para curar la diabetes tipo 1.
Yo también investigo...
¿y tú?
Juntos podremos encontrar una cura para la diabetes tipo 1.






