
DR. Benoit Gauthier
Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER)
SEVILLA, SPAIN
El proyecto del Dr. Benoit Gauthier
Activación de LRH1 mediada por BL001 para promover la transdiferenciación de células alfa a células beta en un modelo de diabetes autoinmune.
1. INTRODUCCIÓN
Estrategias diseñadas separadamente, bien para bloquear el sistema inmune o bien para regenerar la masa de células beta destruídas en el proceso autoinmune de la Diabetes Mellitus Tipo 1(DMT1) no han tenido el éxito esperado en su aplicación clínica. Estrategias que aborden simultáneamente la tolerancia inmune y la regeneración de las células beta supondrían un gran avance para terapias curativas de DMT1.
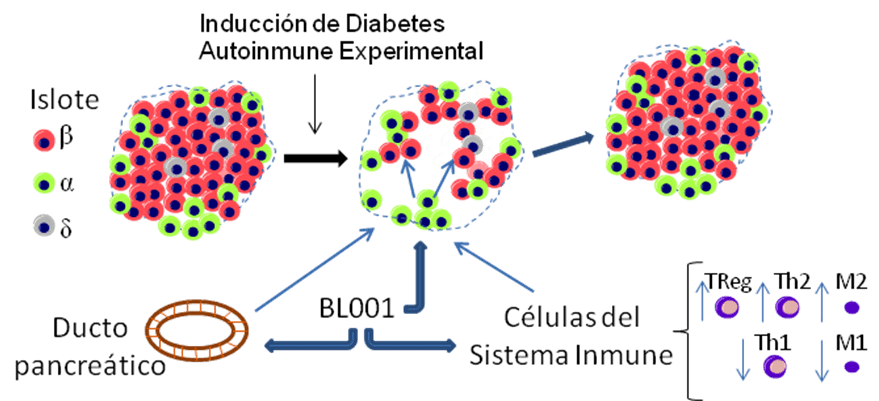
Nuestro grupo ha demostrado previamente que la activación del Receptor Homólogo 1 de Hígado (LRH1) por la molécula BL001 disminuye la incidencia de diabetes experimental autoinmune en ratones. BL001 tiene dos mecanismos de acción: 1) sobre las células del sistema inmune disminuyendo la respuesta autoinmunitaria, al favorecer poblaciones inmunitarias anti-inflamatorias. 2) sobre las células del islote pancreático promoviendo regeneración mediante una potencial conversión de células que reemplazan a las células beta que se han perdido, y mediante la activación de señales para producir dichas transformaciones celulares.
Basándonos en nuestros datos preliminares, en el actual proyecto investigaremos el origen del reemplazo de las células beta, y estableceremos la importancia de las células inmunitarias para dicho reemplazo y para una posible tolerización activada por BL001. Se abordarán tres objetivos: 1) Examinar el impacto de BL001 sobre la transdiferenciación alfa-a-beta en ratón y determinar si específicamente las células inmunitarias Treguladoras (Tregs) y macrófagos M2 potencian este proceso, 2) Evaluar en ratones la contribución de las células ductales a la reposición del conjunto de células alfa bajo el tratamiento con BL001 y 3) Explorar en células humanas la capacidad de BL001 para transformar células alfa humanas en células beta humanas, y si los macrófagos M2 humanos facilitan este proceso.

Imagen: www.hospitalgermanstrias.cat
Centro Cabimer, en Isla de La Cartuja, Sevilla SPAIN.
2. Grupo de investigación
- El grupo de Investigación está liderado por el Dr. Benoit Gauthier, dentro del departamento de Células Troncales del Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER). La denominación del grupo es PIDRU Lab, por las siglas en inglés de Laboratorio de Regeneración y Desarrollo de Islotes Pancreáticos ( http://www.cabimer.es/web3/en/research-groups/pancreatic-islet-development-regeneration/ )
Los miembros del grupo de investigación son los siguientes:
Investigador Principal: Dr. Benoit R. Gauthier
Investigadores Seniors:
Petra Isabel Lorenzo Ovejero
Alejandro Martín-Montalvo Sánchez Investigadores Postdoctorales:
Esther de la Fuente Martín
José Manuel Mellado Gil
Investigadores Asociados:
- Nadia Cobo Vuilleumier
Investigadores Predoctorales:
Irene de Gracia Herrera Gómez
Livia López Noriega Personal Técnico:
Noelia García Rodríguez
- Leopoldo Pérez Rosendo
El grupo mantiene colaboraciones activas con el Hospital Regional e IBIMA en Málaga, el Hospital Puerta del Mar en Cádiz, y en Madrid con el hospital La Paz y la Universidad Complutense.
Medios disponibles
El laboratorio del solicitante y su institución cuentan con toda la infraestructura y medios técnicos para la realización del presente proyecto. Adicionalmente, existe una colaboración con el Dr. Patrick Collombat, líder mundial en el campo de la transdiferenciación de célula alfa a célula beta, que aportará modelos animales de marcaje de seguimiento y linaje de células alfa y ductales y compartirá recursos con el solicitante. Sin embargo son necesarias esta y otras ayudas solicitadas para los gastos destinados a los consumibles, mantenimiento de las colonias animales, personal dedicado, etc., para contribuir una ejecución más eficaz del proyecto.
Equipo
En este proyecto participarán activamente los siguientes miembros del grupo de Investigación:
- Benoit Gauthier (Investigador Principal).
- Patrick Collombat (Investigador Principal-Colaborador).
- Nadia Cobo (Investigadora Colaboradora).
- Jose Manuel Mellado Gil (Investigador Colaborador).
- Técnico de Laboratorio: Noelia García Rodríguez.
- Asimismo participarán en fases puntuales del proyecto los investigadores Alejandro Montalvo, Esther de la Fuente y Petra Isabel Lorenzo.
Artículos científicos del grupo relacionados con DMT1 y estrategias para su posible curación:
- Lorenzo PI, Fuente-Martin E, Brun T, Cobo-Vuilleumier N, Jimenez-Moreno CM, de Gracia Herrera Gomez I, Lopez Noriega N, Mellado-Gil JM, Martin-Montalvo A, Soria B, and Gauthier BR. Pax4 Defines an Expandable β-Cell Subpopulation in the Adult Pancreatic Islet. Scientific Reports-UK. 2015.
- Mellado-Gil JM, Jiménez-Moreno C, et al., and Gauthier BR. Pax4 Preserves Endoplasmic Reticulum Integrity Preventing Beta Cell Degeneration In Type 1 Diabetes Mellitus. Diabetologia, 2015
- Baquié, M., St-Onge, L., Kerr-Conte, J., Cobo-Vuilleumier, N., Lorenzo, P.I., Jimenez Moreno, C.M., Cederroth, C.R., Nef, S., Borot, S., Bosco, D., Wang, H., Marchetti, P., Pattou, F., Wollheim, C.B. and Gauthier, B.R. The Liver receptor homolog-1 (LRH-1) is expressed in human islets and protects b-cells against stress-induced apoptosis. 2011. Hum. Mol. Genet. 20:2823-33.
- Jose Mellado-Gil, Taylor C. Rosa, Cem Demirci, Jose A. Gonzalez-Pertusa, Silvia Velazquez-Garcia, Sara Ernst, Shelley Valle, Rupangi C. Vasavada, Andrew F. Stewart, Laura C. Alonso, and Adolfo Garcia-Ocaña. Disruption of hepatocyte growth factor/c-Met signaling enhances pancreatic beta-cell death and accelerates the onset of diabetes. Diabetes VOL: 60(2) PÁGs: 525/536, 2011.
- Hu He, K.H., Lorenzo, P.I., Brun, T., Jimenez Moreno, C.M., Aeberhard, D., Cornu, M., Thorel, F., Gjinovci, A., Thorens, B., Herrera, P.L., Meda, P., Wollheim, C.B., and Gauthier, B.R., In vivo conditional Pax4 overexpression in mature islet β-cells prevents stressed-induced hyperglycemia in mice. 2011. Diabetes. 60: 1705-15.
Resultados preliminares del Proyecto presentado a la convocatoria se han expuesto en los siguientes Congresos Internacionales:
- The LRH1 Agonist BL001 Simultaneously Targets Immune and Islet Cells to Repress Type 1 Diabetes Cobo-Vuilleumier N, Lorenzo PI, et al., and Gauthier BR.
Ponencia Oral. 76th Annual ADA Meeting. 2016. New Orleans (USA) - Agonist-mediated activation of LRH-1 blunts development of hyperglycemia in the RIP-B7.1 mouse model of experimental autoimmune diabetes without adverse effects.
Cobo-Vuilleumier N, Fuente-Martín E, et al., and Gauthier BR.
Póster. Immunology of Diabetes Society 14th International Congress. 2015. Munich (Germany) - The LRH-1 agonist BL001 improves human islet survival and blunts development of hyperglycaemia in the RIP-B7.1 mouse model of experimental autoimmune diabetes.
Cobo-Vuilleumier N, Baquie M, Bugliani M, et al., and Gauthier BR.
Ponencia Oral. 49th Annual EASD Meeting, 2013. Barcelona (Spain).

Fuente: El Correo de Andalucía – https://elcorreoweb.es/sevilla/unos-mecenas-llamados-pacientes-XN3179462
El investigador Benoit Gauthier –en primer plano– con su equipo en el centro Cabimer de la Cartuja. / Pons
3. Proyecto de investigación
3.1 INTRODUCCIÓN
OBJETIVO GLOBAL
En una primera ronda de financiación por la JDRF (#17-2013-372), verificamos la seguridad y el valor terapéutico de BL001 para revertir la diabetes experimental autoinmune en modelo de ratón transgénico específico para la enfermedad (RIP-B7.1). Este proyecto se propone como continuación de ese anterior, y tiene como objetivo analizar las acciones específicas de este compuesto sobre los mecanismos de transdiferenciación y de neogénesis de las células del islote, con la finalidad de regenerar la masa de células beta en un modelo de DMT1. Asimismo, estudiaremos la implicación de las células del sistema inmune en estos procesos.
FUNDAMENTO
La realización de los experimentos propuestos en esta memoria nos permitirá entender los mecanismos de acción de BL001/LRH1 en el proceso de regeneración de la masa de células beta, así como determinar la implicación del sistema inmune en este proceso. Este proyecto está orientado a la búsqueda y mejora de nuevos fármacos basados en la activación de LRH1, puesto que descubrir la contribución de BL001 a la transdiferenciación de células alfa, potencialmente asistida por células inmunes, guiará al desarrollo de una terapia inmunoregenadora basada en un simple fármaco para el tratamiento de la DMT1.
ANTECEDENTES
La diabetes tipo 1 (DMT1) está causada por un ataque autoinmune contra las células beta productoras de insulina. La destrucción de las células beta, y consiguiente falta de insulina, da lugar a una elevación crónica de la glucosa en sangre (hiperglucemia) tóxica para el organismo.
El tratamiento convencional de la DMT1 con insulina, aunque vital, no actúa sobre la causa de la enfermedad y no evita las graves complicaciones secundarias de la DMT1 (1). Por tanto, es urgente encontrar tratamientos que atenúen el ataque autoinmune específico sobre las células beta (tolerancia) a la vez que promuevan la supervivencia y regeneración de estas células (2,3).
El ataque autoinmune sobre las células beta es iniciado por los macrófagos M1 y continuado por los linfocitos Th1 autorreactivos que las destruyen, causando una inflamación en el entorno del islote (insulitis). Sin embargo, dentro del sistema inmune existen células que controlan y suprimen la acción de los linfocitos Th1, que son los linfocitos Tregs y Th2 y los macrófagos M2, que atenúan la respuesta inmune y reparan los tejidos, evitando que el estado inflamatorio se cronifique y se perpetúe la destrucción de las células beta. En el contexto de la DMT1 la respuesta pro-inflamatoria sobrepasa a la respuesta anti-inflamatoria, y sería de enorme interés terapéutico activar mecanismos que inclinaran la balanza hacia un aumento funcional de esas poblaciones celulares con acciones antiinflamatorias (4). Por otro lado, se ha demostrado in vivo que las células alfa pueden transformarse a células beta cuando éstas son destruidas extensivamente en determinadas condiciones. Este mecanismo denominado transdiferenciación ofrecería una potencial alternativa para regenerar la masa de células beta, por lo que sería de notable importancia identificar dianas a las que dirigir fármacos para activar este proceso (5,6).
Por ello, la identificación y caracterización de dianas modificables por fármacos, que estén implicadas tanto en el aumento de la tolerancia inmune, como en promover la supervivencia y regeneración de la célula beta a través de la transdiferenciación tendrán un gran impacto en el desarrollo de terapias curativas para la DMT1.
En esa línea, nuestro grupo ha demostrado que la activación del receptor homólogo 1 del hígado (LRH1) por una pequeña molécula sintética BL001, atenuó la respuesta inmune y redujo drásticamente la incidencia de hiperglucemia en un modelo de DMT1. Determinar si existen mecanismos de transdiferenciación de célula alfa a beta inducidos por BL001 será el objetivo principal de este proyecto.
NOVEDAD DEL PROYECTO
Es la primera vez que se identifica una diana terapéutica individual que combine la propiedad de promover la regeneración de nuevas células productoras de insulina y la reprogramación de las células alfa con la asistencia de los Tregs y macrófagos M2. Estas características la hacen única y su aplicación puede ser enormemente beneficiosa para los pacientes de DMT1, puesto que es capaz de modificar el entorno autoinmune y, a raíz de ello, incrementar la masa de células beta. Prueba del potencial terapéutico de este proyecto es la colaboración con una compañía biotecnológica para la síntesis y ensayos de una nueva generación de moléculas que mejoren las propiedades farmacológicas de BL001, de cara a poder ser utilizado como fármaco en ensayos clínicos a medio plazo.
HIPÓTESIS
La activación de LRH1 mediada por BL001 promueve por un lado la transdiferenciación de células alfa pancreáticas a células beta y tiene un efecto directo sobre determinadas poblaciones del sistema inmune promoviendo la regeneración del islote pancreático.
3.2. OBJETIVOS ESPECÍFICOS Y DESARROLLO DEL PROYECTO
OBJETIVOS
Para verificar nuestra hipótesis y desarrollar este proyecto, proponemos tres objetivos específicos:
1. Examinar el impacto de BL001 sobre la transdiferenciación alfa-a-beta en ratón y determinar si Tregs y macrófagos M2 potencian este proceso.
Discerniremos si la modificación del balance de las poblaciones inmunes por BL001 propicia la transdiferenciación de célula alfa a célula beta, o es el efecto directo de BL001 sobre las células alfa. Provocaremos la destrucción de las células beta, y lo combinaremos con un marcaje y seguimiento (trazado del linaje) de las células alfa pancreáticas, que nos permitirá seguir la procedencia y el destino de las células alfa y ver si se transforman en células beta después de la destrucción de éstas últimas. 1) Para evaluar la acción directa de BL001 a la transdiferenciación en ausencia de un ataque autoinmune, una única inyección de una dosis alta de estreptozotocina (STZ, toxina que destruye selectivamente a las células beta), será administrada a ratones Glu-rtTA::TetO-Cre::ROSA26-lox-stop-lox-YFP, cuyas células alfa están marcadas con una proteína fluorescente. 2) Para evaluar la contribución de Tregs y macrófagos M2 a la transdiferenciación de células alfa a célula beta, combinaremos el modelo RIP-B7.1 de diabetes autoinmune experimental (DAE) inducida con el de marcaje y seguimiento de células alfa Glu-rtTA::TetO-Cre::ROSA26-lox-stop-lox-YFP. Así generaremos el modelo RIP-B7.1::Glu-rtTA::TetO- Cre::ROSA26-lox-stop-lox-YFP, que tendrá las células alfa marcadas con una proteína fluorescente y en el que induciremos diabetes autoinmune. En ambos modelos de seguimiento de células alfa y destrucción de células beta (STZ y DAE), los ratones serán pre-tratados con BL001 5 días antes de la inducción del daño. Posteriormente se determinarán los niveles de glucosa en sangre durante 8 semanas para establecer la incidencia de diabetes. Durante esas 8 semanas, se realizarán análisis del tejido pancreático en varios puntos temporales mediante inmunohistoquímica para detectar el porcentaje de células beta originadas por antiguas células alfa, así como moléculas/marcadores que se expresan durante la conversión de célula alfa a células beta. También se evaluará la infiltración de Tregs y macrófagos M2 mediante inmunofluorescencia y citometría de flujo. Posteriormente, para explorar si el reclutamiento por medio de BL001 de Tregs y macrófagos M2 está actuando sobre la conversión de célula alfa a beta, se suprimirán estas poblaciones celulares en el modelo combinado de seguimiento de célula alfa y diabetes autoinmune experimental, y se analizarán los parámetros descritos anteriormente.
2. Evaluar la contribución de las células ductales a la reposición del conjunto de células alfa bajo el tratamiento con BL001.
Las células ductales, localizadas en los conductos de la porción exocrina del páncreas, pueden originar células alfa nuevas (neogénesis). Determinaremos si BL001 estimula la neogénesis de nuevas células alfa, que posteriormente podrían transdiferenciarse a células beta.
En este caso combinaremos el modelo de diabetes autoinmune experimental (RIP-B7.1) con modelos de marcaje de células ductales para posterior trazado del linaje (HNF1b-creER::ROSA26-lox-stop-lox-B- Gal o Sox9-creER::ROSA26-lox-stop-lox-B-Gal). Así obtendremos ratones con las células ductales marcadas con una proteína fluorescente, para facilitar el seguimiento de las mismas, y en los que podremos inducir diabetes autoinmune experimental (DAE), denominados RIP-B7.1::HNF1b- creER::ROSA26-lox-stop-lox-B-Gal o RIP-B7.1::Sox9-creER::ROSA26-lox-stop-lox-B-Gal. Induciremos DAE en animales pre-tratados o no con BL001 5 días antes y mediante análisis de inmunohistoquímica determinaremos si hay células beta que proceden de las células ductales.
3. Explorar la capacidad de BL001 para promover la conversión de células alfa humanas a células beta humanas y si los macrófagos M2 humanos facilitan este proceso.
Examinaremos la acción de BL001 “in vitro” en tejidos/células humanas. Por un lado, si induce cambios directamente en células del sistema inmune, y por otro si los cambios potenciales inducidos por BL001 en macrófagos afectan a la conversión de células alfa a beta en el islote pancreático humano.
Puesto que es imposible adquirir Tregs humanos específicos de antígeno, utilizaremos inicialmente células mononucleares humanas de la sangre (PBMCs), tanto de donantes sanos como de pacientes con DMT1. Inicialmente se inducirá la maduración de los macrófagos de esas células sanguíneas, y posteriormente serán tratadas con BL001. Tras los tratamientos se caracterizarán las poblaciones de macrófagos en PBMCs para determinar subtipos M1 y M2, mediante técnicas de ELISA, citometría de flujo y qPCR. En paralelo, islotes humanos serán modificados para el marcaje de las células alfa, que nos permitirá el seguimiento posterior de las citadas células. Para ello los islotes serán transducidos con dos constructos lentivirales, que porten por un lado el promotor de ARX para la expresión de Cre (pARX-Cre), y por otro pCMV-LoxP-Stop-LoxP-GFP. El Dr. Collombat, colaborador en este proyecto, demostró recientemente que el promotor de ARX es más eficiente que el de glucagón para marcar específicamente a las células alfa, y así tendremos un mayor número de ellas marcadas con la proteína fluorescente. Nuestro protocolo optimizado y publicado recientemente será utilizado para la modificación (transducción) de los islotes humanos. A continuación, estos islotes humanos con las células alfa marcadas serán tratados con BL001. También islotes humanos modificados cultivados simultáneamente con macrófagos humanos (co-cultivos), serán tratados con BL001. Al final de los tratamientos, secciones de los islotes humanos serán procesadas para inmunohistoquímica donde se determinarán porcentaje de células alfa convertidas en células beta y otros marcadores de este proceso.
PLAN DE CUMPLIMIENTO DE LOS OBJETIVOS DE INVESTIGACIÓN
Milestones* | |
0-6 meses |
|
6-12 meses |
|
12-18 meses |
|
18-24 meses |
|
3.3. FACILIDADES DISPONIBLES Y BIBLIOGRAFÍA
El proyecto se realizará en su mayor parte en el Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER) en Sevilla, en la Unidad de Desarrollo y Regeneración de los Islotes Pancreáticos, liderado por el Dr. Benoit Gauthier, cuyo laboratorio está completamente equipado con aparatos de última tecnología. CABIMER ocupa un edificio de más de 9.000 m2 y alberga 20 laboratorios distribuidos en 4 departamentos: Células Troncales y Reprogramación Celular, Señalización Celular, Biología Molecular y Terapia Celular y Medicina Regenerativa. Cuenta con 10 unidades de apoyo diversas instalaciones básicas (recursos biológicos-animalario, histología, citometría, cultivos celulares, genómica, microscopía, organismos modelo, lavado y esterilización, isótopos y seguridad biológica y un laboratorio GMP), que son accesibles como servicio de pago por uso. CABIMER cuenta con el equipamiento esencial para la adecuada realización del proyecto. Las instalaciones de cultivo celular incluyen áreas para cultivos de líneas celulares, cultivos primarios y un laboratorio de bioseguridad P2 para estudios con virus. La Unidad de Genómica está completamente equipada con la plataforma de microarray Affymetrix. La unidad de microscopía cuenta con dos microscopios confocales y cinco microscopios de fluorescencia. La unidad de histología cuenta con equipamiento para el procesado automático de los tejidos para su inclusión en parafina. CABIMER dispone además de otros equipos de uso común: dos ABI 7500 adicionales, un sistema de PCR a tiempo real Light Cycler 480, así como centrífugas, un lector Varioskan Flash Spectral Scanning Multimode, un luminómetro Glomax, un escáner Typhoon 9400, un equipo escaner Odyssey para generación de imágenes por infrarrojo, 2 sistemas de procesamiento de imagen BioRad Gel Doc XR, dos espectrofotómetros nanodrop ND-1000, un analizador genético ABI Prism, 2 sonicadores de sonda Branson Digital Sonifier, 2 sonicadores de baño Diagenode Bioruptor, además de varias cámaras de temperatura regulada. Este centro cuenta con unas instalaciones para animales con racks microventilados que tienen capacidad para 6.000 ratones. Estas instalaciones cuentan con tres cuidadores de animales bajo la supervisión del director de instalaciones del centro y un veterinario para controlar la salud de los animales. Finalmente indicar que los laboratorios y oficinas del centro están equipados con ordenadores de última generación, que son actualizados por el departamento de informática de forma continua con el software más reciente. Por lo tanto, CABIMER cuenta con todos los recursos necesarios para llevar a cabo con éxito la experimentación preclínica propuesta en el presente proyecto.
BIBLIOGRAFÍA
- Atkinson MA, Eisenbarth GS, Michels AW: Type 1 diabetes. Lancet 2014;383:69-82
- Gitelman SE, Bluestone JA: Regulatory T cell therapy for type 1 diabetes: May the force be with you. J Autoimmun 2016;71:78-87
- Riley KG, Pasek RC, Maulis MF, Dunn JC, Bolus WR, Kendall PL, Hasty AH, Gannon M: Macrophages are essential for CTGF-mediated adult beta-cell proliferation after injury. Mol Metab 2015;4:584-591
- Cabrera SM, Rigby MR, Mirmira RG: Targeting regulatory T cells in the treatment of type 1 diabetes mellitus. Curr Mol Med 2012;12:1261-1272
- Chung CH, Hao E, Piran R, Keinan E, Levine F: Pancreatic beta-cell neogenesis by direct conversion from mature alpha-cells. Stem Cells 2010;28:1630-1638
- Thorel F, Nepote V, Avril I, Kohno K, Desgraz R, Chera S, Herrera PL: Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature 2010;464:1149-1154

Imagen de la visita de miembros de DiabetesCERO al Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER).
DiabetesCERO
INVESTIGACIONES QUE FINANCIAMOS

Dra. Rosa Gasa
IDIBAPS
——
Generación de células productoras de insulina a partir de células de la piel. Diseño de un armazón y mejora de la revascularización mediante inhibición de PTP1B.

Dr. Benoit Gauthier
CABIMER
——
Activación de LRH1 mediada por BL001 para promover la transdiferenciación de células alfa a células beta en un modelo de diabetes autoinmune.

Dra. Marta Vives
IGTP
——
Nanopartículas tipo liposoma que reeducan el sistema inmunológico para permitir la regeneración de las células beta.

Estela Rosell
Universitat de Lleida / IRB Lleida
——
Desarrollo de una microbioterapia efectiva para el tratamiento de la diabetes tipo 1.

Dra. Mireia Ramos
Universitat Pompeu Fabra
——
Entender la heterogeneidad de las células beta para curar la diabetes tipo 1.
Yo también investigo...
¿y tú?
Juntos podremos encontrar una cura para la diabetes tipo 1.






