
Dr. Benoit Gauthier
Centro Andaluz de Biología Molecular y Medicina Regenerativa (CABIMER)
SEVILLA, SPAIN
AVANCES EN EL ÚLTIMO AÑO
Avances en el proyecto de Benoit Gauthier
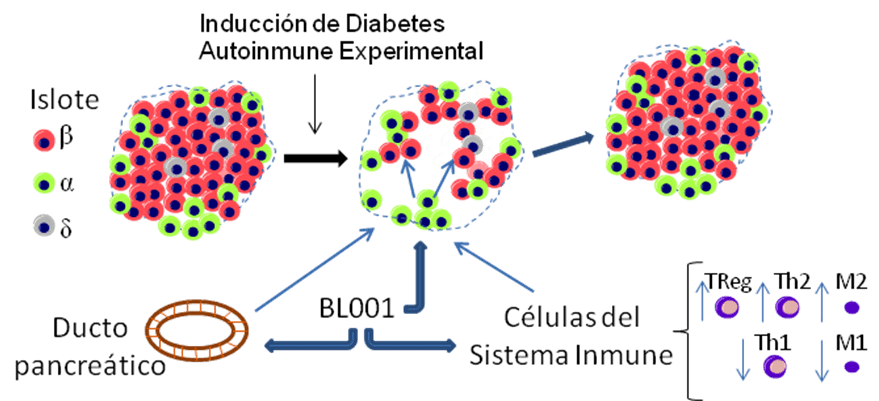
Activación de LRH1 mediada por BL001 para promover la transdiferenciación de células alfa a células beta en un modelo de diabetes autoinmune.
Actualizado: 24-02-2023
1. Introducción
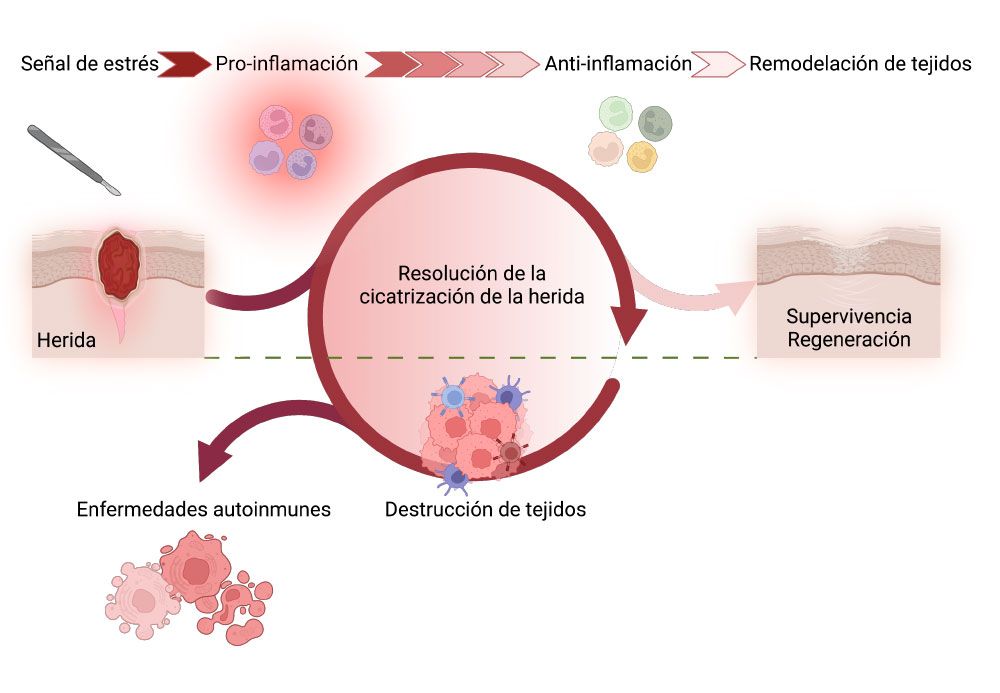
Figura 1. La Diabetes de tipo 1 puede ser considerada como un proceso de cicatrización de heridas no resuelto en el que la fase proinflamatoria persiste en un ciclo continuo que da lugar a la destrucción de las células beta y a la hiperglucemia. El concepto consiste en cortar este ciclo vicioso para resolver la cicatrización de heridas y progresar hacia la regeneración/homeostasis tisular. Adaptado de Cobo vuilleumier et al., Metabolism 104:154137, 2020.
2. Avances 2021-2022
1. La activación de LRH-1/NR5A21 mediada por BL001 reprograma genéticamente la célula alfa a un fenotipo de célula beta.
En los últimos años, hemos validado mediante estudios de rastreo de linaje celular en los que las células alfa de los islotes pancreáticos se marcan irreversiblemente mediante la expresión del marcador fluorescente YFP que la activación de LRH-1/NR5A2 por BL001 en un entorno hiperglucémico provoca la reprogramación genética de las células alfa a un fenotipo de célula beta caracterizado por la expresión de marcadores clave como INSULINA, PDX1 y GLP1R. Esta reprogramación celular se caracterizó por la activación de rutas genéticas implicadas en la matriz extracelular, importante para la cicatrización de heridas, así como en la neurogénesis, que comparten similitudes con la diferenciación de las células beta (Fig. 2).
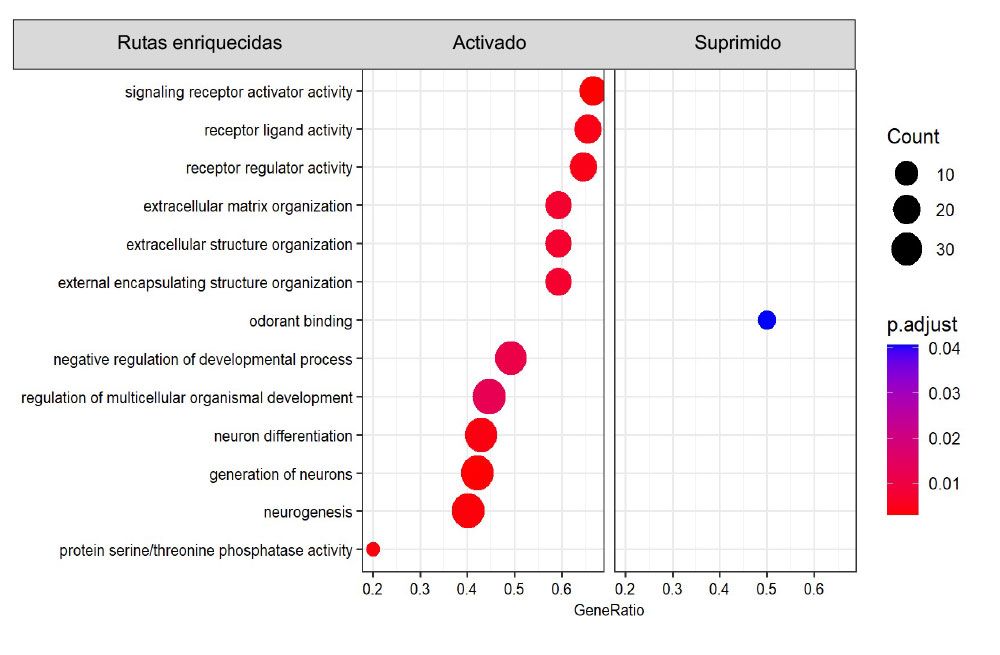
Figura 2. BL001 activa las vías genéticas implicadas en la cicatrización de heridas y la diferenciación de células beta en células alfa en fase de transdiferenciación. Datos no publicados.
2. NR5A2/LRH-1 regula la ruta PTGS2-PGE2-PTGER1 contribuyendo a la supervivencia y función de los islotes pancreáticos
Además, demostramos que la ablación de LRH-1/NR5A2 específicamente en las células beta adultas suprimía la acción antidiabética del BL001 en ratones, lo que se correlacionaba con una mayor destrucción de las células beta y una menor inducción de Ptgs2, uno de los genes más regulados en los islotes tratados con BL001. La inactivación de PTGS2 en los islotes condujo a niveles reducidos de su producto PGE2 y a la reducción de la protección de BL001 contra la apoptosis inducida por citocinas. Demostramos que el bloqueo del receptor de PGE2 PTGER1 anuló la supervivencia de los islotes mediada por BL001 frente a la apoptosis inducida por citoquinas. Nuestros resultados definen el eje de señalización LRH-1/PTGS2/PGE2/PTGER1 como una ruta clave en la mediación de las propiedades de supervivencia de BL001 (Fig. 3). (https://www.sciencedirect.com/science/article/pii/S2589004222006162?via%3Dihub).
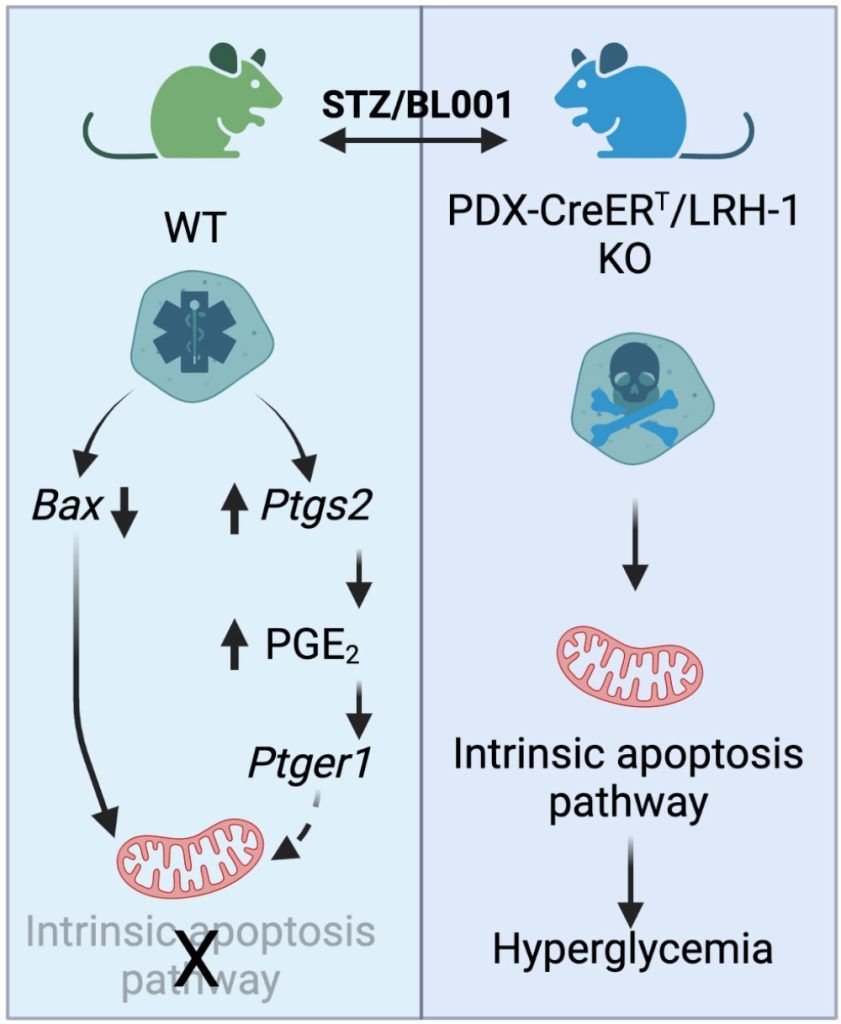
Figura 3. BL001 media su acción prosupervivencia y antidiabética a través de la ruta de señalización LRH1/NR5A2/PTGS2/PGE2/PTGER1 en células beta. Adaptado de Martin Vazquez et al, iScience 25:104345, 2022.
3. El agonismo de LRH-1/NR5A2 reconfigura el inmunometabolismo favoreciendo un fenotipo antiinflamatorio en las células inmunitarias de donantes con DT1 y aumenta la supervivencia y la función de los implantes de islotes.
También trasladamos nuestros datos murinos a células inmunitarias humanas obtenidas de individuos con DT1, demostrando la capacidad del BL001 para reducir la expresión de marcadores proinflamatorios y citoquinas de macrófagos así como de células dendríticas, y al mismo tiempo aumentar las células T reguladoras (Tregs) importantes para suprimir el ataque autoinmune. Más importante, la expansión de las células T citotóxicas implicadas en la destrucción de las células beta se redujo cuando se expusieron a células dendríticas y Tregs tratadas con BL001. A nivel molecular, BL001 inmunoparalizó los macrófagos proinflamatorios y al mismo tiempo aumentó el metabolismo mitocondrial en las células dendríticas promoviendo un fenotipo tolerogénico. También demostramos que la administración de BL001 a ratones diabéticos inmunocompetentes trasplantados con islotes humanos mejoró la supervivencia en correlación con la reducción de la hiperglucemia y la preservación de la masa de células beta (Fig. 4). Nuestros resultados establecen que BL001 puede inducir un cambio fenotípico pro a anti-inflamatorio en las células inmunes humanas, y mejorar el trasplante/función de islotes humanos, apoyando los beneficios terapéuticos de BL001 en humanos. Este trabajo se ha realizado en colaboración con el IGTP de Barcelona, el Hospital Puerta del Mar de Cádiz, el Hospital Virgen de Macarena de Sevilla y el Biobanco Andaluz.
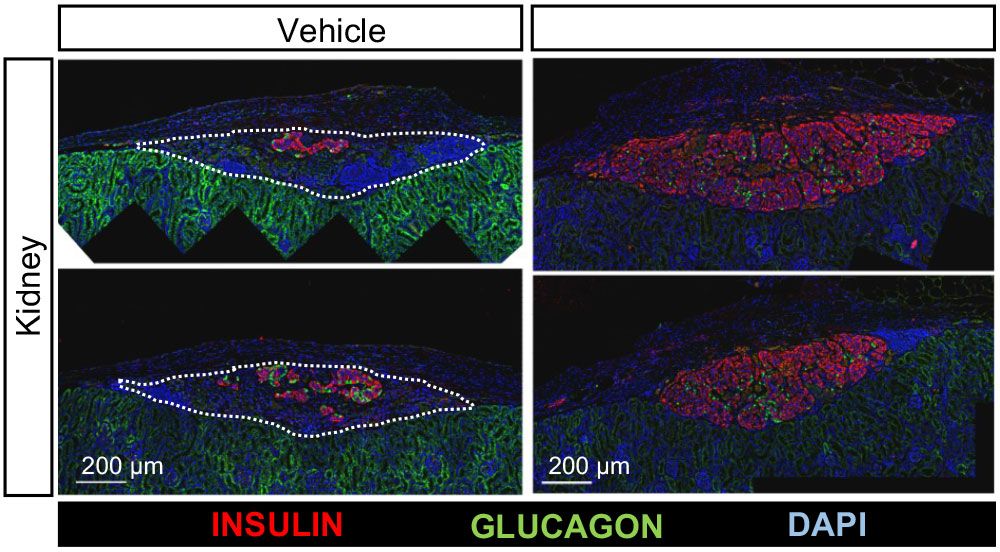
Figura 4. El agonista de LRH-1/NR5A2 BL001 preserva la masa y la funcionalidad de los islotes humanos trasplantados bajo la cápsula renal de ratones inmunocompetentes. Datos no publicados.
4. Modelización de la Diabetes Tipo 1 in vitro utilizando organoides de islotes derivados de células madre pluripotentes inducidas (IPSC) y células inmunes obtenidas de individuos afectados
Para comprender mejor la compleja interacción entre las células inmunitarias y las células de los islotes y el impacto de BL001 de forma holística, estamos modelizando la DT1 in vitro utilizando organoides de islotes derivados de IPSC y células inmunitarias obtenidas de individuos enfermos. Este trabajo se realiza en colaboración con el Profesor Decio Eizirik en el Instituto de Investigación de la Diabetes en Bruselas, BE (Fig. 5). Inicialmente demostramos que los organoides de islotes recapitulan fielmente el efecto pro-supervivencia del BL001 observado con islotes humanos tratados con citoquinas. Esta investigación está en desarrollo.
(https://www.sciencedirect.com/science/article/pii/S2589004222006162?via%3Dihub).
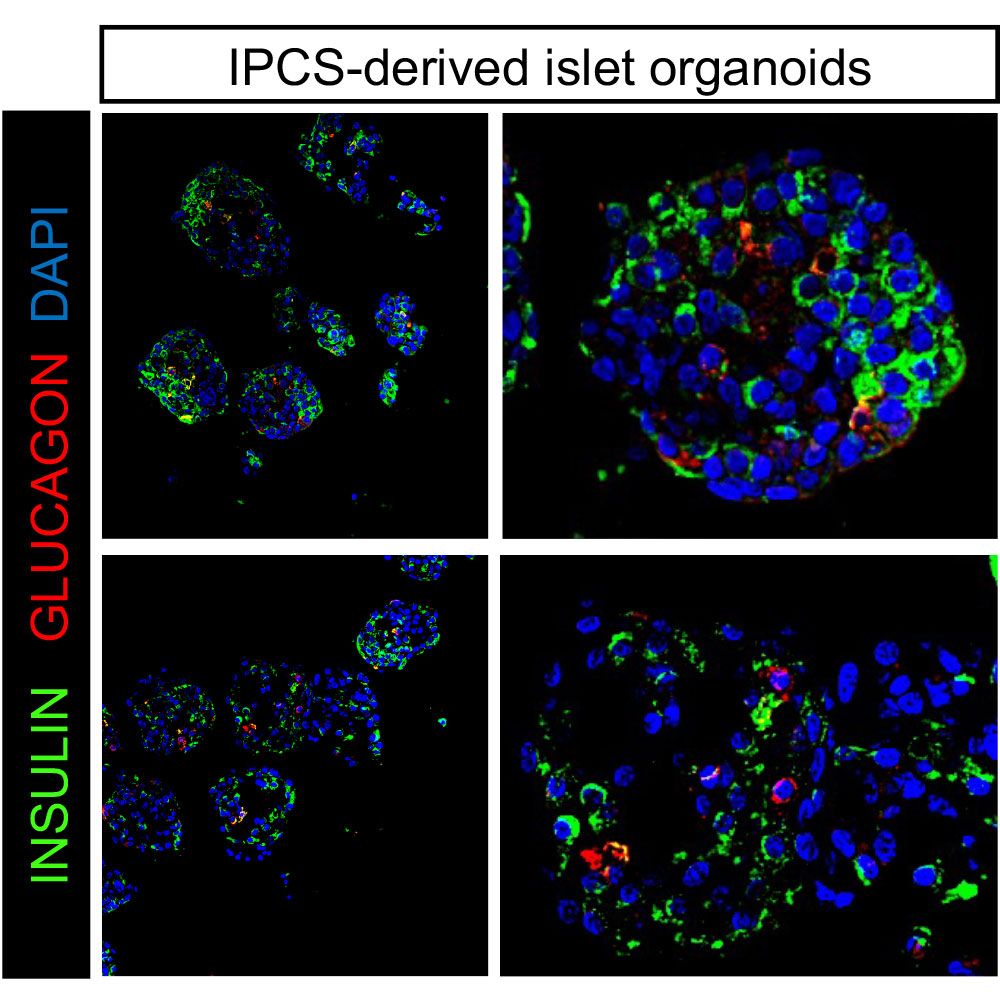
Figura 5. Las IPSC se diferenciaron en células endocrinas pancreáticas mediante un protocolo de 7 pasos. Imágenesinmunofluorescentes representativas de organoides de islotes. Adaptado de Martin Vazquez et al, iScience25:104345, 2022.
3. Publicaciones destacadas (2021-2022)
- Martin Vázquez E, Cobo-Vuilleumier N, Araujo Legido R, Marín-Cañas S, Nola E, Dorronsoro A, López Bermudo L, Crespo A, Romero-Zerbo SY, García-Fernández M, Martin Montalvo A, Rojas A, Comaills V, Bérmudez-Silva FJ, Gannon M, Martin F, Eizirik D, Lorenzo PI, Gauthier BR. 2022. NR5A2/LRH-1 regulates the PTGS2-PGE2-PTGER1 pathway contributing to pancreatic islet survival and function. iScience. 25:104345.
- Gauthier BR, Rubio-Contreras D, Gómez-Rosado JC, Capitán-Morales LC, Soria Escoms B, Lachaud CC. 2022. Human Omental Mesothelial Cells Impart an Immunomodulatory Landscape Impeding B and T-cell activation Int. J. Mol. Sci. 22:4239.
- González-Mariscal I, Pozo-Morales M, Romero-Zerbo SY, Espinosa-Jimenez V, Escamilla-Sánchez A, Sánchez-Salido L, Cobo-Vuilleumier N, Gauthier BR, Bermúdez-Silva FJ. 2022. Abnormal cannabidiol ameliorates inflammation preserving pancreatic beta cells in mouse models of experimental type 1 diabetes and beta cell damage. Biomed. Pharmacother. 145:112361.
- Lorenzo PI, Cobo-Vuilleumier N, Martín-Vázquez E, López-Noriega L, Gauthier BR. 2021. Harnessing the Endogenous Plasticity of Pancreatic Islets: A Feasible Regenerative Medicine Therapy for Diabetes? Int. J. Mol. Sci. 22:4239
4. Grupo de investigación
Investigador Principal:
- Benoit R. Gauthier
Investigadores Seniors:
- Nadia Cobo Vuilleumier
- Petra Isabel Lorenzo Ovejero
Investigadores Postdoctoral:
- Valentine Comaills
- Christian Lachaud
- Jaime Muños Franco
- Akaitz Dorronsoro González
- Livia López Noriega
Investigadores Predoctorales:
- María Eugenia Martin Vázquez García
Personal Técnico:
- Cristina Cerrada Romero
- Daniel De Lllano Teixeira
- Pedro Antonio Soriano Gonzalez
- Raquel Araujo Legido

Equipo de investigación del Dr. Benoit Gauthier en el Centro Cabimer, en Isla de La Cartuja, Sevilla SPAIN. 2022.

Dr. Benoit Gauthier
CABIMER
Activación de LRH1 mediada por BL001 para promover la transdiferenciación de células alfa a células beta en un modelo de diabetes autoinmune.
LOS OTROS
PROYECTOS DE INVESTIGACIÓN
QUE FINANCIAMOS

Dra. Rosa Gasa
IDIBAPS
Generación de células productoras de insulina a partir de células de la piel. Diseño de un armazón y mejora de la revascularización mediante inhibición de PTP1B.
¡Conoce las últimas novedades!

Dra. Marta Vives
IGTP
Nanopartículas tipo liposoma que reeducan el sistema inmunológico para permitir la regeneración de las células beta.
¡Conoce las últimas novedades!
Yo también investigo...
¿y tú?
Juntos podremos encontrar una cura para la diabetes tipo 1.




